Hướng dẫn ngắn gọn, thực tiễn về Quy phạm thực hành sản xuất tốt (GMP). Bao gồm các khung pháp lý (21 CFR), hệ thống quản lý chất lượng, tài liệu, xác nhận quy trình, kiểm tra, tính toàn vẹn dữ liệu (ALCOA+), và các thực hành tối ưu—được thiết kế riêng cho nhà sản xuất và labo nha khoa mong muốn vận hành nhất quán, tuân thủ quy định.

Mục lục [Hiển thị]
- Tổng Quan
- Giới Thiệu & Định Nghĩa
- Nguyên Tắc Cốt Lõi của FDA GMP
- Khung Pháp Lý
- Yêu Cầu Chính của GMP
- Yêu Cầu Tài Liệu
- Kiểm Soát & Xác Nhận Quy Trình
- Kiểm Soát Chất Lượng & Kiểm Tra
- Tuân Thủ & Thanh Tra
- GMP Theo Ngành
- Tính Toàn Vẹn Dữ Liệu Trong GMP
- Quản Lý Rủi Ro Trong GMP
- Đào Tạo & Năng Lực
- Quản Lý Nhà Cung Cấp
- Cải Tiến Liên Tục
- Hội Nhập Toàn Cầu
- Tương Lai của GMP
- Thực Hành Triển Khai Tối Ưu
- Kết Luận
Tổng Quan
Quy phạm thực hành sản xuất tốt (GMP), tên đầy đủ là Quy phạm thực hành sản xuất tốt hiện hành (CGMP), là khung nền tảng của FDA, nhằm đảm bảo sản phẩm an toàn, hiệu quả và đồng nhất. Hệ thống CGMP kiểm soát thiết kế, giám sát và quản lý toàn bộ quy trình sản xuất và cơ sở đối với các sản phẩm do FDA quản lý (thực phẩm, dược phẩm, sinh phẩm và thiết bị y tế). Bài viết này cung cấp cái nhìn tổng quan thực tiễn, có cơ sở học thuật, phù hợp với kỳ vọng ngành nha khoa và tư duy chất lượng của các tổ chức tuân thủ FDA/ISO như XDENT LAB.
Giới Thiệu & Định Nghĩa
CGMP là các tiêu chuẩn hiện hành của FDA về chất lượng sản xuất, nhằm đảm bảo sản phẩm an toàn khi sử dụng và chứa đúng thành phần, hàm lượng như công bố. Từ “hiện hành” nhấn mạnh rằng các yêu cầu luôn cập nhật theo tiến bộ công nghệ và thực hành tối ưu hiện đại. CGMP đặt ra yêu cầu tối thiểu cho phương pháp, cơ sở vật chất và kiểm soát trong sản xuất, đóng gói, ghi nhãn, lưu trữ, lắp đặt và bảo trì sản phẩm hoàn chỉnh.
Nguyên Tắc Cốt Lõi của FDA GMP
CGMP tập trung vào thực hành chất lượng hiện đại, dựa trên rủi ro và hệ thống, có khả năng thích ứng khi công nghệ phát triển.
Ý Nghĩa “Hiện Hành” trong CGMP
Quy định liên tục cập nhật theo công nghệ và tiêu chuẩn.
Đòi hỏi cải tiến liên tục (phương pháp, kiểm soát, thiết bị).
Hệ thống lỗi thời có nguy cơ không tuân thủ.
Quy định linh hoạt giúp hiện đại hóa quy trình.
Yêu Cầu Cơ Bản
CGMP quy định phương pháp, cơ sở vật chất và kiểm soát đối với thiết kế, sản xuất, đóng gói, ghi nhãn, lưu trữ, lắp đặt và bảo trì thiết bị dùng cho người—và áp dụng nguyên tắc tương tự cho thực phẩm, thuốc và sinh phẩm.
Khung Pháp Lý
FDA thực thi CGMP thông qua quy định đã được mã hóa và kiểm tra trực tiếp, dựa trên quyền lực pháp lý.

Nền Tảng Pháp Lý
21 CFR Phần 210–211: GMP cho dược phẩm.
21 CFR Phần 820: Quy định hệ thống chất lượng thiết bị y tế (QSR).
21 CFR Phần 110–117: GMP cho thực phẩm.
21 CFR Phần 600–680: Sản phẩm sinh học.
21 CFR Phần 225–226: GMP cho thuốc thú y.
Quyền Thực Thi
Kiểm tra cơ sở, giám sát và kiểm tra đột xuất.
Thư cảnh báo, cảnh báo nhập khẩu, tịch thu, lệnh cấm.
Xử phạt dân sự và hình sự đối với vi phạm.
Tuân thủ bắt buộc—CGMP không phải là tùy chọn.
Yêu Cầu Chính của GMP
CGMP nhấn mạnh hệ thống quản lý chất lượng (QMS) toàn diện bao gồm lãnh đạo, nguồn lực, quy trình và giám sát.
Hệ Thống Quản Lý Chất Lượng
Trách nhiệm quản lý: chính sách chất lượng, cơ cấu tổ chức, nguồn lực, đánh giá quản lý, lập kế hoạch chất lượng.
Quản lý nguồn lực: trình độ nhân sự, đào tạo, cơ sở vật chất, thiết bị phù hợp, kiểm soát môi trường.
Thực hiện sản phẩm: kiểm soát thiết kế, kiểm soát mua hàng, lập kế hoạch sản xuất, xác nhận quy trình, nhận diện và truy xuất nguồn gốc.
Đo lường & phân tích: giám sát, phân tích dữ liệu, CAPA (hành động khắc phục/phòng ngừa), cải tiến liên tục.
Yêu Cầu Đối Với Nhân Sự
Tiêu chuẩn trình độ và năng lực rõ ràng.
Hồ sơ đào tạo và đánh giá định kỳ.
Trách nhiệm tuân thủ quy trình và báo cáo sai lệch.
Vệ sinh, sạch sẽ và nhận thức về tác động chất lượng.
Cơ Sở & Thiết Bị
Cơ sở: diện tích đủ, xây dựng kiên cố, phòng ngừa nhiễm bẩn, giám sát môi trường, chương trình bảo trì.
Thiết bị: thiết kế/lắp đặt/xác nhận vận hành/đánh giá hiệu suất; chương trình hiệu chuẩn.
Yêu Cầu Tài Liệu
Tài liệu là nền tảng của CGMP, đảm bảo truy xuất nguồn gốc, đồng nhất và sự tin cậy trong quản lý.
Tài Liệu Tổng Thể
Sổ tay chất lượng và quy trình thao tác chuẩn (SOP).
Hồ sơ lô tổng thể và thông số kỹ thuật.
Quy trình xác nhận và báo cáo xác nhận.
Quản lý phiên bản, kiểm soát thay đổi, phân phối kiểm soát.
Lịch lưu trữ và hệ thống điện tử đã xác nhận.
Hồ Sơ Sản Xuất
Hồ sơ sản xuất và kết quả kiểm tra.
Báo cáo sai lệch và điều tra.
Hồ sơ xuất xưởng và phân loại lô.
Truy xuất nguyên liệu, kiểm soát quá trình, kiểm tra cuối cùng.
Hồ sơ phân phối và quản lý khiếu nại.
Kiểm Soát & Xác Nhận Quy Trình
Xác nhận quy trình chứng minh rằng quy trình luôn tạo ra sản phẩm đáp ứng thông số kỹ thuật đã định trước.
Xác Nhận Quy Trình
Thiết kế quy trình: thu thập kiến thức, hiểu quy trình, đánh giá rủi ro, chiến lược kiểm soát, nghiên cứu mở rộng quy mô.
Xác nhận quy trình: xác nhận thiết bị và cơ sở, xác nhận hiệu suất, kiểm tra quy trình, tài liệu hóa.
Giám sát quy trình liên tục: theo dõi thường xuyên, phân tích xu hướng, kiểm soát thay đổi, kích hoạt xác nhận lại, cơ hội cải tiến.
Kiểm Soát Thay Đổi
Nhận diện thay đổi và đánh giá tác động chính thức.
Đánh giá rủi ro, phê duyệt, kiểm soát triển khai.
Kiểm tra hiệu quả và giám sát sau thay đổi.
Kiểm Soát Chất Lượng & Kiểm Tra

Kiểm soát phòng thí nghiệm đảm bảo nhận diện, hàm lượng, chất lượng, độ tinh khiết và hiệu suất, được hỗ trợ bởi phương pháp xác nhận và thiết bị hiệu chuẩn.
Kiểm Soát Phòng Thí Nghiệm
Kiểm tra nguyên liệu đầu vào, quá trình và sản phẩm hoàn chỉnh.
Nghiên cứu độ ổn định và giám sát môi trường.
Xác nhận phương pháp và tiêu chuẩn tham chiếu.
Quản lý mẫu, chuỗi bảo quản và báo cáo dữ liệu.
Thông Số & Tiêu Chuẩn
Nhận diện, hàm lượng/hoạt lực và các thuộc tính chất lượng quan trọng.
Đặc điểm độ tinh khiết và hiệu suất.
Tiêu chí chấp nhận dựa trên khoa học, thống kê và rủi ro.
An toàn bệnh nhân là yếu tố giới hạn cuối cùng.
Tuân Thủ & Thanh Tra
FDA xác minh CGMP qua kiểm tra tập trung vào hiệu quả hệ thống và tính toàn vẹn dữ liệu.
Quy Trình Kiểm Tra FDA
Kiểm tra trước cấp phép, giám sát định kỳ, kiểm tra đột xuất và tái kiểm tra.
Giám sát sau lưu hành và đánh giá có mục tiêu.
Tập trung vào xác nhận, kiểm soát thay đổi, xử lý khiếu nại và tính toàn vẹn dữ liệu.
Các Lỗi Thường Gặp
Quy trình chưa đầy đủ và tài liệu kém.
Thiếu xác nhận và đào tạo không hiệu quả.
Điều tra và CAPA chưa đạt yêu cầu.
Quan ngại về tính toàn vẹn dữ liệu và nguy cơ nhiễm bẩn.
Lỗi kiểm soát quy trình và thiếu giám sát quản lý.
GMP Theo Ngành
Dù nguyên tắc CGMP là phổ quát, các yêu cầu chuyên biệt sẽ điều chỉnh kiểm soát phù hợp với từng loại sản phẩm.
GMP Dược Phẩm (21 CFR 210–211)
Kiểm soát hoạt chất và phòng ngừa nhiễm chéo.
Ngày hết hạn, mẫu lưu, xuất xưởng lô.
Các khu vực trọng yếu: xử lý vô trùng, hệ thống nước, HVAC, kỹ thuật vô khuẩn.
GMP Thiết Bị Y Tế (21 CFR 820)
Kiểm soát thiết kế: lập kế hoạch, đầu vào, đầu ra, đánh giá, xác nhận/kiểm chứng.
Kiểm soát sản xuất: hồ sơ tổng thể/lịch sử thiết bị, quy trình đặc biệt, kiểm soát tự động hóa.
GMP Thực Phẩm (21 CFR 110–117)
Kiểm soát vệ sinh và quản lý dị ứng.
Xác minh chuỗi cung ứng và kiểm soát phòng ngừa.
Yêu cầu HARPC và phân tích nguy cơ.
Tính Toàn Vẹn Dữ Liệu Trong GMP
Dữ liệu đáng tin cậy là nền tảng cho mọi yếu tố CGMP; nguyên tắc ALCOA+ và kiểm soát hồ sơ điện tử là trọng tâm.
Nguyên Tắc ALCOA+
Attributable (Có thể quy trách nhiệm): ai thực hiện hoạt động.
Legible (Rõ ràng): dễ đọc và lưu giữ lâu dài.
Contemporaneous (Đúng thời điểm): ghi lại khi thực hiện.
Original (Gốc): nguồn ghi nhận đầu tiên.
Accurate (Chính xác): không lỗi.
Thêm: đầy đủ, nhất quán, lâu dài, sẵn sàng.
Hồ Sơ Điện Tử (21 CFR Phần 11)
Xác nhận hệ thống và nhật ký kiểm tra.
Chữ ký điện tử và kiểm soát truy cập.
Sao lưu dữ liệu, lưu trữ và phục hồi sau thảm họa.
Quản Lý Rủi Ro Trong GMP
Quản lý rủi ro chất lượng tích hợp đánh giá và kiểm soát rủi ro có cấu trúc vào hệ thống QMS.
Quản Lý Rủi Ro Chất Lượng
Nhận diện, phân tích, đánh giá rủi ro.
Kiểm soát rủi ro và chu kỳ đánh giá.
Tích hợp với thiết kế, xác nhận và kiểm soát thay đổi.
Công Cụ & Phương Pháp
FMEA và HACCP.
Phân tích cây lỗi.
Ma trận xếp hạng rủi ro.
Kiểm soát quá trình thống kê và phân tích năng lực.
Đào Tạo & Năng Lực
Nhân sự có năng lực đảm bảo quy trình được thực hiện nhất quán và an toàn.
Chương Trình Đào Tạo
Kiến thức nền tảng GMP và đào tạo theo vị trí công việc.
Cập nhật quy định và quy trình an toàn.
Nhận thức và văn hóa chất lượng.
Tài Liệu
Hồ sơ đào tạo và đánh giá năng lực.
Ma trận chứng nhận và lịch đào tạo lại.
Đánh giá hiệu quả đào tạo.
Quản Lý Nhà Cung Cấp
Kiểm soát nhà cung cấp chặt chẽ bảo vệ chất lượng nguyên liệu và sự đồng nhất quy trình.
Đánh Giá Nhà Cung Cấp
Đánh giá, kiểm tra nhà cung cấp và thỏa thuận chất lượng.
Giám sát hiệu suất và đánh giá rủi ro.
Đánh giá liên tục và danh sách nhà cung cấp đã phê duyệt.
Biện Pháp Kiểm Soát
Kiểm tra nguyên liệu đầu vào và chứng chỉ phân tích.
Thông báo thay đổi và chỉ số chất lượng.
Truy xuất nguồn gốc toàn chuỗi cung ứng.
Cải Tiến Liên Tục
Đánh giá quản lý và CAPA thúc đẩy duy trì chất lượng và khả năng tuân thủ quy định lâu dài.
Đánh Giá Quản Lý
Chỉ số chất lượng, kết quả kiểm tra, xu hướng khiếu nại.
Hiệu suất quy trình và hiệu quả CAPA.
Phân bổ nguồn lực và lộ trình cải tiến.
Sáng Kiến Cải Tiến
Tối ưu hóa quy trình và nâng cấp công nghệ.
Cải tiến đào tạo và hệ thống.
Áp dụng đổi mới thận trọng.
Hội Nhập Toàn Cầu
CGMP hài hòa với các tiêu chuẩn quốc tế để đảm bảo chất lượng toàn cầu và mở rộng thị trường.

Tiêu Chuẩn Quốc Tế
Hướng dẫn ICH cho dược phẩm.
Tiêu chuẩn ISO (ví dụ ISO 13485 cho thiết bị, ISO 9001 cho QMS).
Khuyến nghị của WHO và PIC/S.
Quy định khu vực và công nhận lẫn nhau.
Tương Lai của GMP
CGMP tiếp tục phát triển nhờ công nghệ và giám sát dựa trên rủi ro.
Xu Hướng Mới
AI, sản xuất liên tục, giám sát thời gian thực.
Phân tích dự đoán và blockchain cho truy xuất nguồn gốc.
Chỉ số chất lượng, thiết kế hướng đến bệnh nhân, đảm bảo chuỗi cung ứng.
Bền vững và yếu tố môi trường.
Thực Hành Triển Khai Tối Ưu
Xây dựng văn hóa GMP là cam kết chiến lược—vượt xa yêu cầu tối thiểu.
Xây Dựng Văn Hóa GMP
Cam kết lãnh đạo và giao tiếp rõ ràng.
Gắn kết nhân viên và trách nhiệm cá nhân.
Học tập liên tục và phân bổ nguồn lực hợp lý.
Đầu tư đào tạo và chương trình ghi nhận.
Lỗi Thường Gặp
Thiếu nguồn lực và phản ứng thụ động.
Tài liệu kém và vận hành rời rạc.
Chỉ tập trung tuân thủ mà thiếu sự bền vững quy trình.
Kết Luận
CGMP của FDA cung cấp khung toàn diện, luôn cập nhật để đảm bảo an toàn, chất lượng và hiệu quả cho sản phẩm quản lý. Thành công dựa trên văn hóa chất lượng mạnh, quy trình xác nhận, dữ liệu tin cậy và cải tiến liên tục. Đối với các phòng khám nha khoa và đối tác, tuân thủ kỳ vọng FDA/ISO xây dựng niềm tin và sự nhất quán trong quy trình dự phòng và phục hồi—đúng với triết lý dịch vụ lab-to-lab và hệ thống chất lượng của XDENT LAB.
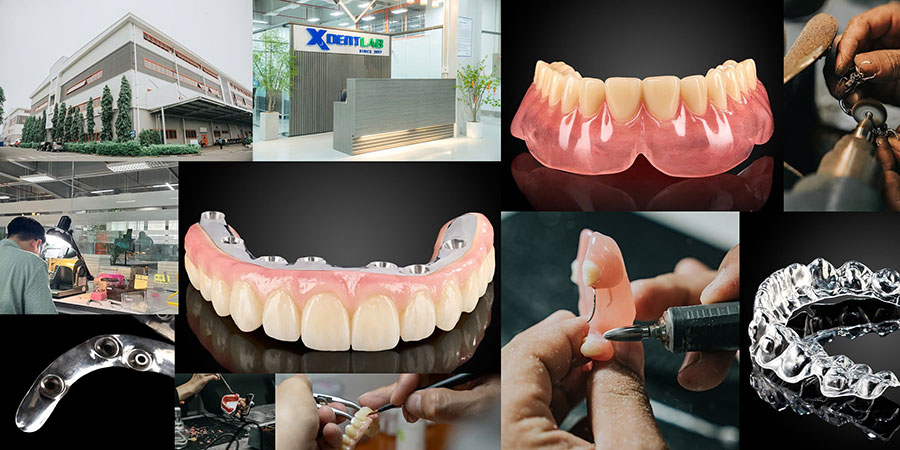
XDENT LAB là chuyên gia trong lĩnh vực Dịch vụ Lab-to-Lab tổng thể đến từ Việt Nam. Nổi bật với các dịch vụ phục hình tháo lắp và phục hình trên implant, đáp ứng tiêu chuẩn thị trường Hoa Kỳ – được FDA và ISO chứng nhận. Thành lập năm 2017, XDENT LAB đã phát triển từ quy mô địa phương vươn tầm quốc tế, hiện sở hữu 2 nhà máy và hơn 100 nhân viên. Công nghệ hiện đại, đội ngũ kỹ thuật viên được chứng nhận và cam kết tuân thủ quy định, giúp XDENT LAB trở thành lựa chọn tin cậy cho các phòng labo nha khoa mong muốn đảm bảo chất lượng và sự đồng nhất cho sản phẩm của mình.
Cam kết của chúng tôi:
- 100% vật liệu được FDA phê duyệt.
- Sản xuất quy mô lớn, năng suất cao, tỷ lệ làm lại < 1%.
- Thời gian hoàn thành trong labo 2~3 ngày (*áp dụng cho file kỹ thuật số).
- Tiết kiệm chi phí lên đến 30%.
- Sản xuất liên tục 365 ngày/năm, không gián đoạn.
Liên hệ với chúng tôi ngay hôm nay, để xây dựng chiến lược giảm chi phí vận hành.
--------❃--------
Labo Gia Công Nha Khoa Việt Nam - XDENT LAB
🏢 Nhà máy 1: 95/6 Đường Trần Văn Kiểu, Phường Bình Phú, TP. Hồ Chí Minh, Việt Nam
🏢 Nhà máy 2: Khu công nghiệp Kizuna 3, Xã Cần Giuộc, Tỉnh Tây Ninh, Việt Nam
☎ Hotline: 0919 796 718 📰 Nhận báo giá chi tiết
Chia sẻ bài viết này: